멍게추출 ‘항암제’ 치료효과 높일 방법 찾았다
컨텐츠 정보
- 346 조회
-
목록
본문
- IBS 유전체 항상성 연구단, 개인 맞춤형 항암치료 전략기대
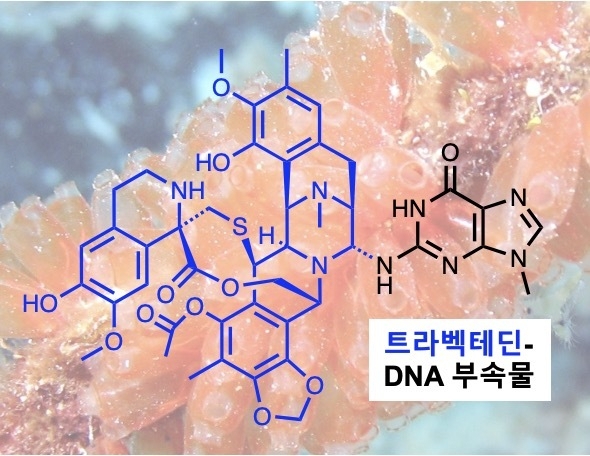 항암제 트라벡테딘트라벡테딘은 카리브해 멍게에서 최초로 추출된 항암 약물로, 세포독성 DNA 부가물을 형성하는 것으로 알려져 있다. 이 약물은 연조직육종과 난소암 치료에 사용되며, 대부분의 항암제와는 달리, DNA 복구기능이 활성화된 세포에서 그 효과를 완전히 발휘한다.[IBS 제공]
항암제 트라벡테딘트라벡테딘은 카리브해 멍게에서 최초로 추출된 항암 약물로, 세포독성 DNA 부가물을 형성하는 것으로 알려져 있다. 이 약물은 연조직육종과 난소암 치료에 사용되며, 대부분의 항암제와는 달리, DNA 복구기능이 활성화된 세포에서 그 효과를 완전히 발휘한다.[IBS 제공]
[헤럴드경제=구본혁 기자] 일반적인 항암 치료에 사용되는 약물은 주로 암세포의 DNA를 공격해 세포의 증식을 억제한다고 알려져 있다. 하지만 암세포도 이에 대응해 약물로 인한 DNA 손상을 복구하는 기능을 활성화해 스스로 회복한다. 항암 치료가 어려운 이유다.
기초과학연구원(IBS) 유전체 항상성 연구단 올란도 쉐러 부연구단장 연구팀은 스위스 취리히 연방 공과대학교와 함께 암세포의 DNA 회복을 막아 항암 치료에 활용되는 약물 ‘트라벡테딘’의 작용 기전을 규명했다. 암세포의 DNA 복구 기전에 따른 맞춤형 치료로 항암 치료 효과를 높이는 데 기여할 것으로 기대된다.
트라벡테딘은 카리브해 멍게 엑티나시디아 터비나타(Ecteinascidia turbinata)에서 최초로 추출된 항암 약물이다. 대부분의 항암 치료에 사용되는 DNA 손상 유발 약물과 달리, DNA 복구 능력이 활발한 암세포에 대해 더욱 독성을 나타내는 특징을 갖는다. 그러나 트라벡테딘이 구체적으로 어떤 메커니즘을 통해 항암 작용을 발휘하는지 명확한 메커니즘은 규명되지 못한 상태였다.
연구팀은 DNA 단일 가닥 절단까지도 미세하게 감지할 수 있는 고효율의 ‘코멧(COMET) 칩’ 실험으로 트라벡테딘의 효과를 비교, 분석했다. 그 결과, 자외선에 의한 DNA 손상은 뉴클레오타이드 절제 복구(NER) 과정을 거쳐 곧 복구됐지만, 트라벡테딘에 의한 DNA 손상은 복구되지 않음을 확인했다.
또한 연구진은 트라벡테딘에 의해 손상이 복구되지 않고 세포 독성이 나타나는 현상을 DNA 복구 핵심 메커니즘 중 하나인 ‘전사 결합 뉴클레오타이드 절제 복구(TC-NER)’가 활발한 세포에서 주로 관찰할 수 있었다. 일반적으로 TC-NER 과정은 DNA의 전사전사 중 손상된 DNA 부분을 인식한 뒤, 손상 부위에 다양한 복구 단백질이 모여 복합체를 형성한다. 그 후, 색소건피증 단백질-F(XPF)와 색소건피증 단백질-G(XPG)에 의해 손상된 부위가 절단되고 제거되며 점차 복구하게 된다. 그러나 트라벡테딘은 TC-NER 과정 중 색소건피증 단백질-G(XPG)에 의한 DNA 절단 작용을 막아 복구 과정을 억제한다. 이로 인해 DNA 복구가 불완전한 상태로 남게 되어, 최종적으로 암세포의 사멸을 유도한다.
 기초과학연구원(IBS) 유전체 항상성 연구단 올란도 쉐러 부연구단장.[IBS 제공]
기초과학연구원(IBS) 유전체 항상성 연구단 올란도 쉐러 부연구단장.[IBS 제공]
연구진은 DNA 손상 부위를 유전체 전반에 걸쳐 확인하는 시퀀싱 방법을 통해 트라벡테딘에 의해 유발된 DNA 손상을 정확하게 식별하고 위치를 파악하는 데 성공했다. 이러한 정보는 트라벡테딘이나 다른 항암제가 암세포의 특정 유전자에 어떻게 작용하는지 이해하는 데 큰 도움을 준다. 특히 TC-NER이 활발한 암세포를 표적으로 하는 환자 개개인의 암 특성에 따른 맞춤형 치료 전략으로 항암 치료 효과를 높일 수 있다.
손국 박사후연구원은 “이번 연구로 트라벡테딘의 작용 메커니즘을 더 깊이 이해할 수 있는 토대를 마련했다”며 “특정 암세포 유형에 대한 트라벡테딘의 치료 효과를 높이는 가능성을 제시한다”고 말했다.
이번 연구 결과는 국제학술지 ‘네이처 커뮤니케이션즈’ 2월 15일 온라인 게재됐다.

[헤럴드경제=구본혁 기자] 일반적인 항암 치료에 사용되는 약물은 주로 암세포의 DNA를 공격해 세포의 증식을 억제한다고 알려져 있다. 하지만 암세포도 이에 대응해 약물로 인한 DNA 손상을 복구하는 기능을 활성화해 스스로 회복한다. 항암 치료가 어려운 이유다.
기초과학연구원(IBS) 유전체 항상성 연구단 올란도 쉐러 부연구단장 연구팀은 스위스 취리히 연방 공과대학교와 함께 암세포의 DNA 회복을 막아 항암 치료에 활용되는 약물 ‘트라벡테딘’의 작용 기전을 규명했다. 암세포의 DNA 복구 기전에 따른 맞춤형 치료로 항암 치료 효과를 높이는 데 기여할 것으로 기대된다.
트라벡테딘은 카리브해 멍게 엑티나시디아 터비나타(Ecteinascidia turbinata)에서 최초로 추출된 항암 약물이다. 대부분의 항암 치료에 사용되는 DNA 손상 유발 약물과 달리, DNA 복구 능력이 활발한 암세포에 대해 더욱 독성을 나타내는 특징을 갖는다. 그러나 트라벡테딘이 구체적으로 어떤 메커니즘을 통해 항암 작용을 발휘하는지 명확한 메커니즘은 규명되지 못한 상태였다.
연구팀은 DNA 단일 가닥 절단까지도 미세하게 감지할 수 있는 고효율의 ‘코멧(COMET) 칩’ 실험으로 트라벡테딘의 효과를 비교, 분석했다. 그 결과, 자외선에 의한 DNA 손상은 뉴클레오타이드 절제 복구(NER) 과정을 거쳐 곧 복구됐지만, 트라벡테딘에 의한 DNA 손상은 복구되지 않음을 확인했다.
또한 연구진은 트라벡테딘에 의해 손상이 복구되지 않고 세포 독성이 나타나는 현상을 DNA 복구 핵심 메커니즘 중 하나인 ‘전사 결합 뉴클레오타이드 절제 복구(TC-NER)’가 활발한 세포에서 주로 관찰할 수 있었다. 일반적으로 TC-NER 과정은 DNA의 전사전사 중 손상된 DNA 부분을 인식한 뒤, 손상 부위에 다양한 복구 단백질이 모여 복합체를 형성한다. 그 후, 색소건피증 단백질-F(XPF)와 색소건피증 단백질-G(XPG)에 의해 손상된 부위가 절단되고 제거되며 점차 복구하게 된다. 그러나 트라벡테딘은 TC-NER 과정 중 색소건피증 단백질-G(XPG)에 의한 DNA 절단 작용을 막아 복구 과정을 억제한다. 이로 인해 DNA 복구가 불완전한 상태로 남게 되어, 최종적으로 암세포의 사멸을 유도한다.

연구진은 DNA 손상 부위를 유전체 전반에 걸쳐 확인하는 시퀀싱 방법을 통해 트라벡테딘에 의해 유발된 DNA 손상을 정확하게 식별하고 위치를 파악하는 데 성공했다. 이러한 정보는 트라벡테딘이나 다른 항암제가 암세포의 특정 유전자에 어떻게 작용하는지 이해하는 데 큰 도움을 준다. 특히 TC-NER이 활발한 암세포를 표적으로 하는 환자 개개인의 암 특성에 따른 맞춤형 치료 전략으로 항암 치료 효과를 높일 수 있다.
손국 박사후연구원은 “이번 연구로 트라벡테딘의 작용 메커니즘을 더 깊이 이해할 수 있는 토대를 마련했다”며 “특정 암세포 유형에 대한 트라벡테딘의 치료 효과를 높이는 가능성을 제시한다”고 말했다.
이번 연구 결과는 국제학술지 ‘네이처 커뮤니케이션즈’ 2월 15일 온라인 게재됐다.
관련자료
댓글 0
등록된 댓글이 없습니다.

























.jpg)



















.jpg)






























